スワーン酸化【Swern Oxidation】

塩化メチレン中、低温で塩化オキサリルにより活性化されたDMSOは、アルコール類と速やかに反応してアルコキシスルホニウム塩を生成し、トリエチルアミン添加により高収率でカルボニルに変換する反応をスワーン酸化といいます。
概要
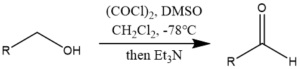 スワーン酸化
スワーン酸化- 初期の中間体は-60℃以上で不安定なため、酸化は通常-78℃で行う
- DMSOの活性化には、TFAAより塩化オキサリルの方が効果的
- 塩化オキサリルを用いた場合、副反応はほとんど起こらない
- 長鎖飽和・不飽和、アセチレン、ステロイドアルコールを低温で高収率に酸化可能
歴史
アメリカの化学者ダニエル・スワーン(Daniel Swern, 1916/01/21 – 1982/12/05, テンプル大学)によって開発された反応です。
反応機構
- 活性化
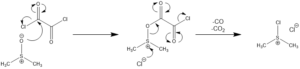
- 酸化
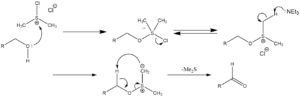
実験手順
塩化オキサリル(2.1mL, 24mmol)のジクロロメタン溶液(30mL)を-78℃に冷却し、ジメチルスルホキシド(3.3mL, 21mmol)のジクロロメタン溶液(32mL)を滴下する。激しいガスの発生が見られる。
5分後、アルコール(4.0g, 20mmol)のジクロロメタン溶液(26mL)を加え、-78℃で15分撹拌する。トリエチルアミン(14.0mL, 100mmol)を一度に加え、-78℃で10分間撹拌した後、徐々に室温に昇温させる。ジクロロメタンで希釈後、飽和塩化アンモニウム水溶液、食塩水(x2)で洗浄し、無水硫酸マグネシウムで乾燥する。
濾過後、溶媒をドラフト内で減圧留去(悪臭のため)し、フラッシュカラムクロマトグラフィ(石油エーテル/酢酸エチル=9/1)で精製。目的のアルデヒドを無色液体として得る(3.88g, 収率96%)。
実験のコツ
- 溶媒は通常ジクロロメタンを用いる。THF・ジエチルエーテルも使用可能。
- 特に精密さを必要としない限り、基質:塩化オキサリル:DMSO:トリエチルアミン=1:2:3:6 のモル比で行うのがスタンダード。
- ジメチルスルフィド由来の悪臭が問題なので、全ての操作はドラフト内で行うこと。使用後のガラス器具は次亜塩素酸水溶液(bleach)に浸すことで、悪臭を除くことが可能。
応用例
第1級アルコールであれば、TES基で保護されていても酸化が進行する。
海洋ドラベラン型ジテルペン(+)-デオキシネオドラベリンの全合成
合成経路の最終段階で1,2-ジオールの第二級ヒドロキシ基を酸化し、α-ヒドロキシケトンを合成する必要がありました。このような1,2-ジオールの多くは酸化条件下で不安定であり、グリコールの開裂が起こります。
実際に、Dess-Martin酸化やLey酸化では基質の炭素-炭素結合が開裂しましたが、Swern酸化の条件下では望みのα-ヒドロキシケトンが65%の収率で得られました。
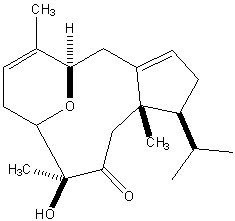 (+)-4,5-Deoxyneodolabelline
(+)-4,5-DeoxyneodolabellineイルシナールAとマンザミン型ルカロイドの合成
本合成では、二か所を同時に酸化する二重Swern酸化が用いられています。
まず、三環性ジオール中間体を-78℃でSwern酸化を行うと、高収率で対応するジアルデヒドが得られました。次に、無塩条件下で過剰のWittig反応剤により、2つの末端アルケンに変換しました。
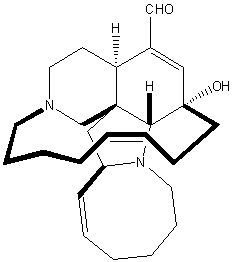 Ircinal A
Ircinal A細胞分裂阻害剤(+)-アステルトキシンの収束型全合成
2つの主要なフラグメントのカップリングは、ビス(テトラヒドロフラン)アルデヒドとα-ピロンホスホナートのHWEオレフィン化によって行われました。
ビス(テトラヒドロフラン)アルデヒドは、ビス(テトラヒドロフラン)第一級アルコールをSwern酸化することにより得られました。
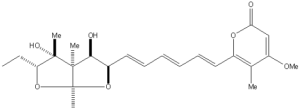 (+)-Asteltoxin
(+)-Asteltoxin関連書籍









