窒素に関する情報をまとめました。
窒素の基本情報
| 和名 | 窒素 |
|---|---|
| 英名 | Nitrogen |
| 語源 | ギリシャ語 「硝石(nitrum)+源(gennao)」 |
| 元素記号 | N |
| 原子量 | 14.01 |
| 常温(25℃)での状態 | 気体 |
| 色 | 無色 |
| 臭い | 無臭 |
| 密度 | 1.2506 g/L (気体, -0.15℃) |
| 融点 | -209.86℃ |
| 沸点 | -195.8℃ |
| 発見者 | ラザフォード(スコットランド, 1772年), ラボアジェ(フランス, 1789年) |
| 含有鉱物 | 硝石 |
窒素の主な特徴
- 自然界では主に二原子分子N2として存在する
- 無色・無臭・無味の気体で、大気中の約78%を占める最も豊富な元素
- 窒素分子N2は三重結合を持ち、非常に安定で反応しにくい一方で、アンモニア(NH3)や硝酸(HNO3)などの化合物では高い反応性を示す
- 生体内ではアミノ酸や核酸の構成要素として不可欠な元素
窒素の歴史
発見
窒素は1772年、スコットランドの化学者ダニエル・ラザフォードによって発見されました。彼は空気中の「燃焼を支えない成分」として窒素を分離しましたが、当初は「有毒な空気」や「窒息性の空気」と呼ばれていました。
名前の由来
「窒素」という名前は、「窒息させる性質」に由来しています。一方、英語名「Nitrogen」は、ギリシャ語の「nitron(硝石)」と「genes(生じる)」を組み合わせたもので、「硝石を生じるもの」という意味です。
窒素の主な用途
窒素はその安定性と不活性さを活かして、以下のような用途に広く使われています:
- 食品保存: 酸化防止や防腐目的で包装内を窒素ガスで充填
- 工業用保護ガス: 酸化防止のため、金属加工や電子部品製造に使用
- 液体窒素: 低温冷却材(約−196℃)として医学・研究・食品冷凍などで活用
- 化学原料: アンモニア(肥料・爆薬・合成樹脂)、硝酸(肥料・染料)などの前駆体
- 医療用途: クライオセラピー(イボ除去など)に液体窒素が使用される
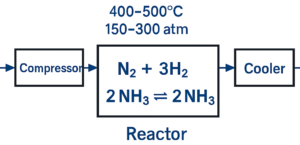
窒素の生成方法
窒素は以下の方法で生成・精製されます:
- 空気の分留: 液化空気を蒸留して酸素・窒素を分離。工業的に最も一般的
- 化学反応による発生: 亜硝酸アンモニウムやアンモニア塩の熱分解(実験室レベル)
- 電気分解(研究用途): 酸化還元反応による窒素の固定と回収
窒素を含む化合物
窒素は多彩な酸化数(−3 ~ +5)を取り、以下のような重要な化合物を形成します:
- アンモニア(NH3): 窒素の最も基本的な化合物。肥料や工業原料
- 硝酸(HNO3): 強酸で酸化性を持ち、肥料・爆薬の原料
- 一酸化二窒素(N2O): 通称「笑気ガス」。麻酔用途や温室効果ガスとして知られる
- 一酸化窒素(NO): 血管拡張など生理作用を持つシグナル分子
- 窒化ホウ素(BN)、窒化ケイ素(Si3N4): 工業用セラミック
窒素に関わる研究事例
窒素は環境科学、生化学、材料科学の分野で注目される研究対象です。主な事例を以下に示します:
- 窒素固定反応: ハーバー・ボッシュ法に代わる低エネルギー固定法(電解法、酵素触媒)の開発
- 窒素循環のモニタリング: 環境中の窒素汚染(硝酸塩、アンモニア)の動態追跡と浄化技術
- バイオロジカルNO研究: NOの神経伝達物質としての役割やがん細胞抑制作用の解明
- 液体窒素冷却技術: 超伝導体・量子コンピュータ冷却における応用展開
- エネルギー変換触媒: 窒素還元を用いたグリーンアンモニア合成の触媒設計研究
筆者の薦める1冊
 第1位
第1位元素に関する問題がレベル別に多く掲載されており、一般的な知識からニッチな知識まで幅広く学べます。また、最後には全元素のデータが載っており、わからないことがあればすぐに調べることができます。
これを読めば、元素マスターに一歩も二歩も近づけます!
リンク
 第2位
第2位この本の一番の魅力は、とても美しい画像とともに学べるということです。
「こんなに美しい元素があったんだ、、!」という新しい発見がたくさんあると思います。
理系に限らず、文系にもおすすめの一冊です。
リンク
 ランキング3位
ランキング3位実は鉱石好きだった宮沢賢治。
教科書にも作品を残す彼の科学者としての一面に注目した一冊です。
リンク