マイケル付加【Michael Addition】
マイケル付加は、電子吸引基を有するα,β-不飽和カルボニル化合物にカルバニオンまたは他の求核剤を求核的に付加させる反応である。共役付加の大きな分類に属し、C-C結合の穏やかな形成に広く用いられている。多くの非対称型が存在する。
概要
- 共鳴安定化カルバニオンの1,4-付加反応(または共役付加反応)
- 熱力学的に制御されており、反応ドナーはマロン酸塩やニトロアルカンなどの活性メチレン類、アクセプターはα,β-不飽和カルボニル化合物などの活性オレフィン類である
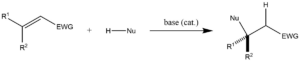
歴史
1887年にタフツ大学のアーサー・マイケルが行った研究は、1884年にコンラッドとクーツァイトが発表した、2,3-ジブロモプロピオン酸エチルとソジオマロン酸ジエチルの反応によるシクロプロパン誘導体(現在は2つの連続した置換反応を伴うと認識)の生成をきっかけとして行われたものです。
マイケルは、プロピオン酸を2-ブロマクリル酸エチルエステルで置き換えることによって同じ生成物を得ることができ、この反応は、アクリル酸の二重結合への付加反応を仮定しなければ成り立たないことに気付いた。そして、マロン酸ジエチルと桂皮酸エチルエステルを反応させ、最初のマイケル付加物を形成することで、この仮定を確認したのである。
同年、ライナー・ルートヴィヒ・クライゼンは、この発明の優先権を主張した。彼とT.コムネノスは、1883年にマロン酸とアルデヒドの縮合反応を研究していた時、副生成物として二重結合への付加生成物を観察していたのである。しかし、伝記作家の所山隆司によれば、この主張には理由がない。
反応機構
反応の経過は、静電的な考察よりもむしろ軌道的な考察によって支配される。安定化エノラートのHOMOは中心炭素原子に大きな係数を持つが、多くのα、β不飽和カルボニル化合物のLUMOはβ炭素に大きな係数を持つ。従って、どちらの反応物もソフトと考えることができる。これらの分極されたフロンティア軌道は同程度のエネルギーであり、効率的に反応して新しい炭素-炭素結合を形成する。
アルドール付加と同様に、マイケル反応もエノール、向山マイケル付加ではシリルエノールエーテル、より一般的にはエノラート求核剤を介して進行することがある。後者の場合、安定化したカルボニル化合物を強塩基で脱プロトン化(ハードエンオール化)、あるいはルイス酸と弱塩基で脱プロトン化(ソフトエンオール化)する。得られたエノラートは活性化されたオレフィンを1,4-位置選択的に攻撃し、炭素-炭素結合を形成する。このとき、エノラートも求電子剤に移行する。親電子体は求核剤よりもはるかに酸性度が低いため、生成物がエノール化可能であれば、通常は迅速なプロトン移動によってエノラートが求核剤に戻る。しかし、適切な求核剤があれば、新しい求核性の場所を利用することができる。求核剤と生成物の相対的な酸性度によって、反応は触媒的な塩基性になることもある。ほとんどの場合、この反応は低温では不可逆的である。
実験手順
更新をお待ちください
実験のコツ
応用例
参考文献
関連書籍







