ブレンステッド・ローリーの酸塩基理論
ブレンステッド・ローリーの酸塩基理論(Brønsted-Lowry acid-base theory)は、1923年にデンマークの化学者ヨハネス・ブレンステッド(Johannes Brønsted)とイギリスの化学者トマス・ローリー(Thomas Lowry)によって独立に提唱された酸と塩基に関する理論です。この理論は、酸と塩基の定義を電子対や水素イオン(H+)のやり取りに基づいて説明します。
本記事では、ブレンステッド・ローリーの酸塩基理論について解説し、酸と塩基の定義や、この理論が化学においてどのように応用されているかを紹介します。
ブレンステッド・ローリーの酸と塩基の定義
ブレンステッド・ローリーの理論では、酸と塩基は次のように定義されます。
- 酸: プロトン(H+)を放出する分子またはイオン。
- 塩基: プロトン(H+)を受け取る分子またはイオン。
この定義では、酸と塩基は互いに対となって反応するものであり、化学反応でプロトンの移動が行われることが重要なポイントです。
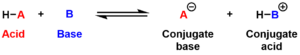
酸の例
酸は、プロトンを放出できる化合物です。代表的な酸には、以下のようなものがあります。
- 塩酸(HCl): 水中でHClはH+を放出し、Cl–を生成します。
- HCl → H+ + Cl–
- 硫酸(H2SO4): 硫酸も強い酸で、プロトンを放出してHSO4–を生成します。
- H2SO4 → H+ + HSO4–
塩基の例
塩基は、プロトンを受け取る化合物です。塩基の代表的な例には、次のようなものがあります。
- 水酸化ナトリウム(NaOH): NaOHは水中でOH–を生成し、酸から放出されたプロトン(H+)を受け取って水(H2O)を形成します。
- OH– + H+ → H2O
- アンモニア(NH3): アンモニアは水溶液中でプロトンを受け取り、アンモニウムイオン(NH4+)を形成します。
- NH3 + H+ → NH4+
共役酸塩基対
ブレンステッド・ローリーの理論では、共役酸塩基対という概念が重要です。酸と塩基の反応では、酸がプロトンを放出すると、その酸に対応する塩基が生成されます。この酸とその生成した塩基を共役酸塩基対と呼びます。
- 共役酸: プロトンを放出する酸(H+を与える分子)。
- 共役塩基: その酸がプロトンを放出して生成された塩基(H+を受け取る分子)。
例えば、塩酸(HCl)がプロトンを放出すると塩化物イオン(Cl–)が生成され、このHClとCl–が共役酸塩基対になります。
例: 水の共役酸塩基対
水(H2O)は、酸としても塩基としても振る舞うことができる両性物質です。以下の例で、水の共役酸塩基対を考えてみます。
- 水が酸として振る舞う場合: 水が酸としてプロトンを放出すると、水はヒドロキシドイオン(OH⁻)を生成します。このとき、水(H2O)とヒドロキシドイオン(OH–)が共役酸塩基対になります。
- H2O → H+ + OH–
- 水が塩基として振る舞う場合: 水が塩基としてプロトンを受け取ると、水はヒドロニウムイオン(H3O+)を生成します。このとき、水(H2O)とヒドロニウムイオン(H3O+)が共役酸塩基対になります。
- H2O + H+ → H3O+
ブレンステッド・ローリーの理論の特徴
ブレンステッド・ローリーの酸塩基理論は、それまでのアレニウスの酸塩基理論と比べ、より広い範囲の酸塩基反応を説明できるという利点があります。この理論では、溶媒に依存せず、プロトンのやり取りが起こる反応全般を酸塩基反応として説明することができます。
溶媒に依存しない
ブレンステッド・ローリーの理論では、反応が必ずしも水中で行われる必要はありません。酸や塩基は、非水溶媒中や気体中でも反応でき、どこでもプロトンの移動が起こると酸塩基反応とみなされます。
- 例: ガス状のHClとNH3の反応でも、HClは酸としてプロトンを放出し、NH3は塩基としてそれを受け取ります。
- HCl(g) + NH3(g) → NH4Cl(s)
広範な適用
アレニウスの理論では、酸は水中でH+(プロトン)を放出する物質、塩基はOH–を放出する物質として定義されていました。しかし、ブレンステッド・ローリーの理論では、酸や塩基は溶媒の種類に関係なく、プロトンを放出したり受け取ったりする能力によって定義されます。
このため、ブレンステッド・ローリーの酸塩基理論は、非水系溶媒中や気相反応など、広範な化学反応を扱うことができ、反応の範囲が広がりました。
酸と塩基の強さ
酸と塩基の強さは、物質がどれだけ容易にプロトンを放出または受け取るかによって決まります。一般的に、酸の強さは酸解離定数(Ka)、塩基の強さは塩基解離定数(Kb)で表されます。
強酸と弱酸
- 強酸は、溶液中で完全にプロトンを放出する酸です。塩酸(HCl)や硫酸(H2SO4)は強酸の例です。
- 弱酸は、溶液中で部分的にしかプロトンを放出しない酸です。酢酸(CH3COOH)や炭酸(H2CO3)が弱酸の例です。
強塩基と弱塩基
- 強塩基は、溶液中で容易にプロトンを受け取り、完全に解離する塩基です。水酸化ナトリウム(NaOH)や水酸化カリウム(KOH)は強塩基の例です。
- 弱塩基は、溶液中でプロトンを部分的にしか受け取らない塩基です。アンモニア(NH3)などがその例です。
ブレンステッド・ローリーの理論の応用
ブレンステッド・ローリーの酸塩基理論は、酸塩基反応の理解において非常に有用であり、化学のさまざまな分野で応用されています。
緩衝液
緩衝液は、共役酸塩基対を用いて作られる溶液で、酸や塩基が加えられた際にpHの変化を抑える働きを持ちます。ブレンステッド・ローリーの理論では、酸とその共役塩基が平衡状態を保つことにより、pHが安定します。
- 例: 酢酸と酢酸ナトリウムの緩衝液
- CH₃COOH ⇌ CH₃COO⁻ + H⁺
酸塩基触媒
多くの化学反応では、酸や塩基が触媒として働くことがあります。これらの触媒は、プロトンを授受することで反応速度を増加させ、特定の反応経路を促進します。
- 例: エステルの加水分解反応における酸触媒
- エステル + 水 ⇌ 酸 + アルコール(H⁺触媒下)
結論
ブレンステッド・ローリーの酸塩基理論は、プロトンの授受に基づいて酸と塩基を定義する理論で、化学反応を幅広く説明することができます。溶媒に依存せず、広範な反応に適用できるため、非水系溶液や気体反応などにも対応するこの理論は、現代化学における酸塩基反応の理解に大きく貢献しています。共役酸塩基対や緩衝液などの概念を通じて、酸塩基の平衡や反応メカニズムを深く理解することができ、化学の多くの分野で応用されています。
この理論を使って、様々な化学反応の性質や進行の予測ができるため、化学研究や産業の現場でも非常に重要です。