【高校化学】有機化合物とは?
有機化合物とは?
有機化合物とは炭素原子を骨格に持つ化合物である。
- 共有結合による構成
- 水に溶けにくく、有機溶媒(油)に溶けやすい
- 融点や沸点が比較的低い
- 空気中で燃焼すると、水と二酸化炭素を発生する
有機化合物は炭素を中心とした骨格を持つ。その他、酸素原子や窒素原子を有することもあるが、基本的に原子の種類は少ない。
しかし、それらの数と構造の組み合わせから、非常に多くの種類がある。
有機化合物の分類
有機化合物の分類方法は色々あるが、ここでは2種類を紹介する。
不飽和度による分類
単結合のみで構成される化合物をアルカン(alkane)といいます。
一方、二重結合を含むものをアルケン(alkene)、三重結合を含むものをアルキン(alkyne)といいます。
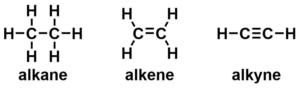
アルカンの炭素原子とそれに付く3つの原子は正四面体となる。
アルケンの炭素原子とそれに付く2つの原子は平面となる。
アルキンの炭素原子とそれに付く1つの原子は直線となる。
結合の距離は、
単結合 > ベンゼン環の炭素間距離 > 二重結合 > 三重結合
※ベンゼン環は全ての炭素間結合が単結合と二重結合の中間の状態となっている
骨格の形による分類
炭素原子が直線状あるいは枝分かれ状になっているものを鎖式という。
それに対して、炭素原子が環状になっているものを環式という。環式の場合、化合物の名前にシクロ-がつく。
有機化合物の表し方
有機化合物の表し方には、構造式、示性式、分子式、組成式の4種類がある。
| 構造式 | 原子間の結合を価標(線)を用いて表した式 |
|---|---|
| 示性式 | 分子式から官能基を分かりやすく示した式 |
| 分子式 | 原子の個数を強調した式 |
| 組成式 | 原子数の比を最も簡単な整数比で表した式 |
例として、酢酸を4種類で表してみる。
構造式
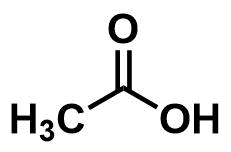
示性式
CH3COOH
分子式
C2H4O2
組成式
CH2O
代表的な官能基
| -OH | ヒドロキシ基.アルコール. |
|---|---|
| -CHO | アルデヒド基.アルデヒド. |
| -CO- | ケトン基.ケトン. |
| -COOH | カルボキシ基.カルボン酸. |
| -O- | エーテル結合.エーテル. |
| -COO- | エステル結合.エステル. |
| -NO2 | ニトロ基.ニトロ化合物. |
| -NH2 | アミノ基.アミン. |
| -SO3H | スルホ基.スルホン酸. |
| -CONH- | アミド結合.アミド. |
| -N=N- | アゾ基.アゾ化合物. |
有機化合物の命名法
アルカンは主鎖の炭素数によって名前が決まる。
| 炭素数 | 名称 |
| 1 | メタン |
| 2 | エタン |
| 3 | プロパン |
| 4 | ブタン |
| 5 | ペンタン |
| 6 | ヘキサン |
| 7 | ヘプタン |
| 8 | オクタン |
| 9 | ノナン |
| 10 | デカン |
主鎖は化合物の中で最も長い直線の炭素鎖である。それ以外は側鎖と呼ばれる。
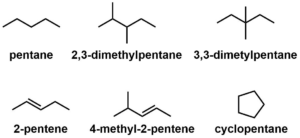
置換基や二重結合、三重結合の位置を示すために番号をつける。
このとき、数字ができるだけ小さくするようにつける。特に、結合に関わる数字が小さくなるようにする。
異性体
一見同じように見えるが、性質が異なる化合物同士の関係を異性体という。
異性体は、構造異性体と立体異性体に分類できる。
構造異性体
構造異性体とは、分子式が同じで構造が異なる異性体のことである。
立体異性体
立体異性体とは、構造式が同じで立体が異なる異性体のことである。
立体異性体は、さらに幾何異性体と光学異性体に分類できる。
幾何異性体
幾何異性体は、cis・transの関係である。
二重結合に注目するとわかる。
光学異性体
光学異性体は、不斉炭素原子を有する化合物に存在し、鏡像関係にある。つまり、右手と左手の関係である。
鏡像異性体ともいう。







