ジュリア・コシエンスキー オレフィン化【Julia-Kocienski Olefination】
ジュリア・コシエンスキーオレフィン化反応は、有機化学における重要なC-C結合形成反応の一つです。特に、天然物や生物活性分子の全合成において、立体選択的にアルケンを形成するための強力なツールとして知られています。この反応の詳細を以下にまとめます。
概要
- ヘテロアリールスルホンとカルボニル化合物との縮合により、アルケンを合成する手法
- 特に(E)-アルケンの選択的合成において高い効率を示す
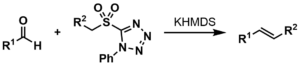
ジュリア・コシエンスキーオレフィン化反応(Julia–Kocienski olefination)は、ヘテロアリールスルホンとカルボニル化合物との縮合により、アルケンを合成する手法です。この反応は、比較的穏やかな条件下で進行し、幅広い基質範囲や官能基許容性を持ち、特に(E)-アルケンの選択的合成において高い効率を示します。従来のWittig反応やHorner–Wadsworth–Emmons (HWE)反応などと比較しても、より高い選択性を持つことが利点です
歴史
ジュリア・リトゴー反応
ジュリアオレフィン化反応は、1973年にMarc Juliaによって初めて報告されました。クラシックなジュリア反応は、フェニルスルホンを使用し、β-アシルオキシスルホンの還元的脱離によってアルケンを形成します。この反応は、4つのステップから構成されており、メタル化、カルボニル化合物への付加、アシル化、最終的な還元的脱離が含まれます。この古典的な手法では、高い立体選択性があり、通常は(E)-アルケンが優先的に生成します。
改良ジュリア反応
1991年にSylvestre Juliaがこの反応を改良し、ベンゾチアゾールスルホンを利用する一段階のオレフィン化反応(修正ジュリアオレフィン化反応)が開発されました。ベンゾチアゾールスルホンを用いることで、生成物の(E)-選択性が向上し、反応の条件が簡素化されました。この反応では、Smiles転位によるスルフィン酸の脱離が進行し、アルケンが直接生成されます。
コシエンスキーの貢献
Kocienskiは、さらなる改良として、1-フェニル-1H-テトラゾール-5-イルスルホン(PTスルホン)を導入しました。この化合物は、自己縮合などの副反応を抑制し、(E)-選択性が高いため、より広範囲な基質に適用可能です。また、反応はワンポットで進行し、従来の複雑なステップを簡略化しました。
反応機構
ジュリア・コシエンスキーオレフィン化反応のメカニズムは、メタル化されたヘテロアリールスルホンがカルボニル化合物に付加し、β-アルコキシスルホン中間体を経てアルケンが生成されるプロセスです。以下は反応の主なステップです:
- メタル化:ヘテロアリールスルホンが強塩基(例: n-BuLi)によってメタル化され、カルボニル化合物との反応に備えます。
- 付加反応:メタル化されたスルホンがアルデヒドやケトンに付加し、β-アルコキシスルホン中間体を生成します。
- Smiles転位と脱離:中間体がSmiles転位を起こし、硫黄酸化物(SO₂)が脱離してアルケンが生成されます。
実験手順
更新をお待ちください
実験のコツ
発展
ジュリア・コシエンスキーオレフィン化反応は、非常に高い(E)-選択性を持ち、特定の条件下では(Z)-アルケンも合成可能です。特に、反応条件の調整により、同じ基質から(E)-アルケンまたは(Z)-アルケンを選択的に合成できる点が注目されています。この反応は、天然物合成や医薬品開発において、複雑なアルケン構造を持つ化合物の合成に広く応用されています。
応用例
参考文献
<Original Publication>
Tetrahedron Letters 1991, 32 (9), 1175–1178.
Synlett 1998, 1998 (01), 26–28.
<Review>
Eur J Org Chem 2009, 2009 (12), 1831–1844.
J. Chem. Soc., Perkin Trans. 1 2002, No. 23, 2563–2585.
Tetrahedron: Asymmetry 2014, 25, 1, 1–55.
関連書籍
関連記事
- HWE反応








