共鳴の概念
共鳴は、有機化学や物理化学で非常に重要な概念で、特定の分子やイオンが単一の構造ではなく、複数の構造(共鳴構造)で表現できることを意味します。共鳴構造は、実際に存在する単一の分子の状態を表しているわけではなく、複数の構造の平均(共鳴混成体)が実際の状態を最もよく説明します。これにより、分子の安定性、反応性、そして電子の分布がより正確に理解できるようになります。
本記事では、共鳴の概念について詳しく解説し、その原理、共鳴構造の描き方、共鳴の重要性や具体例について説明します。
共鳴とは?
共鳴(Resonance)は、分子やイオンの電子配置を1つのルイス構造では正確に表すことができない場合に使われる概念です。このような場合、電子が複数の位置に分布する可能性があり、その状態を示すために複数のルイス構造を描きます。これらの異なる構造を共鳴構造または共鳴式と呼び、共鳴構造の間で実際に電子が揺れ動くわけではなく、実際の分子はこれらの構造の中間的な状態、つまり共鳴混成体として存在しています。
共鳴の原理
共鳴の原理は、電子が分子内で特定の位置に固定されているわけではなく、いくつかの異なる配置の間で「非局在化」しているというものです。この非局在化により、分子全体がより安定な状態になります。
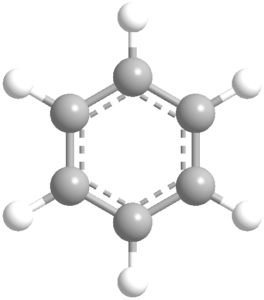
例えば、ベンゼン(C6H6)分子は共鳴の代表的な例です。ベンゼンには、6つの炭素原子が六角形に並んでおり、交互に単結合と二重結合が配置されているように描かれることが一般的です。しかし、実際にはベンゼンの全ての炭素-炭素結合は等価であり、どの結合も完全な単結合でも二重結合でもありません。この現象を説明するために、2つの共鳴構造が描かれますが、実際のベンゼンはその中間である共鳴混成体として存在します。
共鳴構造の描き方
共鳴構造を描く際には、いくつかの重要なルールを守る必要があります。共鳴構造は、分子内での電子の再配置を表すだけであり、原子の位置が変わることはありません。
共鳴構造の描く際のルール
- 原子の配置は変えない: 共鳴構造では、原子核の位置は変わらず、動くのは電子のみです。結合の位置や順序が変わることはありますが、原子自体は動かない点に注意します。
- 結合や孤立電子対の移動: 共鳴構造では、電子がどの結合や非結合電子対に分布するかが異なります。これにより、単結合が二重結合に、または二重結合が単結合になることがあります。また、孤立電子対が結合に寄与することもあります。
- 全体の電荷は変わらない: 共鳴構造を描く際、分子全体の電荷は変わりません。例えば、負の電荷が存在する場合、どの共鳴構造でもその電荷は保持されます。
- 有効なルイス構造であること: それぞれの共鳴構造は、全て有効なルイス構造でなければなりません。したがって、各原子がその結合数と孤立電子対を守り、オクテット則に従う必要があります。
共鳴構造を表す矢印
共鳴構造を示す際には、通常「二重頭矢印(⇄)」を使って、共鳴する構造の間を繋ぎます。これは、実際にはどの構造も単独で存在していないことを示し、分子全体がこれらの構造の混成体として存在することを示しています。
共鳴の重要性と効果
共鳴は、分子の安定性や反応性に大きな影響を与えます。共鳴による電子の非局在化が、分子全体をより安定にし、物理的・化学的性質を決定づけるため、共鳴は重要な役割を果たしています。
共鳴による安定化
共鳴混成体では、電子が複数の結合にわたって分布するため、電子が一箇所に集中することを避け、エネルギーを低下させることができます。これにより、分子全体がより安定した状態になります。このような共鳴による安定化効果は、特に芳香族化合物やカルボカチオン、カルボアニオン、エノールなどの分子において顕著です。
例えば、カルボン酸の共鳴は、カルボン酸の酸性度を高める効果があります。カルボン酸の脱プロトン化により生じるカルボキシラートイオンは、酸素上の負電荷が2つの酸素原子間で非局在化するため、非常に安定です。この共鳴によって、カルボン酸は強い酸性を示します。
反応性への影響
共鳴は分子の反応性にも影響を与えます。特定の位置に電子が集中しているか、非局在化しているかによって、反応の進行具合や生成物が大きく変わることがあります。例えば、芳香族化合物では、共鳴による電子の非局在化が反応性を制御し、特定の位置での置換反応が起こりやすくなります。
電荷の分布
共鳴構造は、分子内の電荷分布を示すために役立ちます。電荷が特定の原子に局在している場合、その原子は反応の活性点となりやすいです。一方で、共鳴によって電荷が複数の原子に分散される場合、特定の反応性が抑えられ、分子全体が安定化することがあります。
共鳴の具体例
ベンゼン(C6H6)
ベンゼンは、共鳴の代表的な例です。ベンゼンは、6つの炭素原子が六角形に結合し、各炭素原子が1つの水素原子と結合しています。ベンゼンの構造は、単結合と二重結合が交互に配置されるように描かれることが多いですが、実際には全ての炭素-炭素結合は等価です。これは、電子が6つの炭素原子間で均等に非局在化しているためです。
共鳴構造を描く際には、単結合と二重結合が交互に配置された2つの構造が描かれますが、実際のベンゼン分子はこれらの構造の中間であり、円環状に電子が分布していると考えられます。
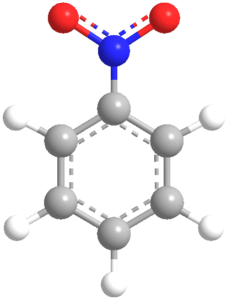
ニトロベンゼン(C6H5NO2)
ニトロベンゼンは、ベンゼン環にニトロ基(NO2)が結合した化合物で、共鳴によって電子の分布が変化します。ニトロ基は電子を引き寄せる効果があり、これによりベンゼン環内の電子が一部非局在化します。これにより、ニトロベンゼンは特定の位置での反応が起こりやすくなります。
カルボニル基(C=O)
カルボニル基も共鳴によって安定化されます。酸素が炭素の電子を引き寄せ、部分的な負電荷を持つ一方で、炭素は正電荷を帯びます。このような電子の分布は、共鳴構造によって説明され、カルボニル基が特定の化学反応でどのように振る舞うかを理解するのに役立ちます。
結論
共鳴は、分子内で電子がどのように分布しているかを正確に理解するために欠かせない概念です。共鳴によって分子全体の安定性が高まり、特定の結合や反応性に影響を与えることがあります。共鳴構造を描くことで、分子の物理的性質や化学的挙動をより正確に予測できるため、共鳴の概念は化学の基本的な理解を深める重要なツールです。
共鳴の例として、ベンゼンやカルボニル基、ニトロベンゼンなどがあり、これらの分子における電子の非局在化が分子の安定性や反応性に影響を与えています。
\さらに有機化学を学びたい方はコチラ/







