バイヤー・ビリガー酸化【Baeyer-Villiger oxidation】
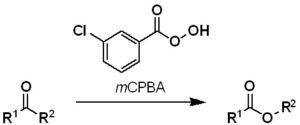
バイヤー・ビリガー酸化は、カルボニルに隣接する炭素-炭素結合の酸化的開裂であり、ケトンをエステルに、環状ケトンをラクトンに変換する。Baeyer-Villigerは、mCPBAのような過酸、または過酸化水素とルイス酸を用いて行うことができる。
反応の位置特異性は、カルボニルに結合した置換基の相対的な移動能力に依存する。正電荷を安定化できる置換基ほど移動しやすく、tert-アルキル>シクロヘキシル>sec.アルキル>フェニル>pr-アルキル>CH3の順となる。場合によっては、立体電子的要因や環の歪み要因も、位置化学的結果に影響を与える。
概要
歴史
1899年、アドルフ・バイヤーとビクター・ビリガーは、現在バイヤー-ビリガー酸化として知られている反応のデモンストレーションを初めて発表した。彼らはペルオキシモノ硫酸を用いて、カンファー、メントン、テトラヒドロカルボンから対応するラクトンを生成した。
Baeyer-Villiger酸化の反応機構には、観察された反応結果と適合すると思われる3つの候補があった。これらの3つの反応機構は、酸素またはカルボニル基の炭素に対するペルオキシ酸攻撃の2つの経路に分けることができる。酸素への攻撃は2つの可能な中間体をもたらす: BaeyerとVilligerはジオキシラン中間体を提案し、Georg WittigとGustav Pieperはジオキシランを生成しない過酸化物を提案した。炭素攻撃はRudolf Criegeeによって提案された。この経路では、過酸がカルボニル炭素を攻撃し、現在Criegee中間体として知られているものを生成する。
1953年、ウィリアム・フォン・エガース・ドーリングとエドウィン・ドーフマンは、ベンゾフェノンの 酸素-18標識を用いて、バイヤー-ヴィリガー酸化の反応機構について正しい経路を解明した。3つの異なるメカニズムは、それぞれ異なる標識生成物の分布につながる。Criegee中間体では、カルボニル酸素のみが標識された生成物が生じる。WittigとPieperの中間体の生成物は、エステルのアルコキシ基のみが標識される。BaeyerとVilligerの中間体では、上記の両方の生成物が1:1で分布する。標識実験の結果はCriegee中間体を支持し、これは現在一般に受け入れられている経路である。
反応機構
実験手順
実験のコツ
発展
応用例
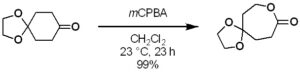
“Total Synthesis of Psammaplysins A, M, O, and Q and Ceratinamide A”
Andrew P. Morrow; Myles W. Smith, J. Am. Chem. Soc., 2024, 146, 5, 2913–2918. DOI: 10.1021/jacs.3c14120
参考文献
関連書籍






