右田・小杉・スティル クロスカップリングは、パラジウム(Pd)を触媒としたクロスカップリング反応の一種で、ハロゲン化アリールやビニル化合物(有機ハロゲン化物)と有機スズ化合物(オルガノスタン)を用いて、炭素−炭素結合を形成する手法です。この反応は、複雑な分子合成において、特に医薬品や有機電子材料の合成に頻繁に使用される優れた手法です。
概要
- パラジウム触媒を用い、有機ハロゲン化物or有機トリフラートと有機スズ化合物間でクロスカップリングを行う手法。パラジウムカップリングの中では相当にマイルドな条件(ほぼ中性条件)で反応が進むため、天然物合成・複雑化合物合成の最終段階で多用される。
- 慢性毒性を示す有機スズ化合物を当量以上必要とする点が最大のデメリット。合成品を生理活性評価に使用する際には注意が必要。
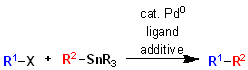
歴史
ハロゲン化アリールと有機スズ試薬のパラジウム触媒によるカップリングの最初の例は、1976年にColin Eabornによって報告された。この反応では、7%から53%のジアリール生成物が得られた。このプロセスは、1977年に右田俊彦によってアシルクロライドとアルキル錫試薬のカップリングに拡張され、53%から87%のケトン生成物が得られた。
1977年、右田はアリルスズ試薬とアリール およびアシルハライドのカップリングに関するさらなる研究を発表した。アリル基がパラジウム触媒に移動しやすくなったため、この反応は低温で行えるようになった。アリールハライドの収率は4%から100%、アシルハライドの収率は27%から86%であった。右田と小杉の初期の貢献を反映して、Migita-Kosugi-Stille couplingと呼ばれることもある。(アメリカなどでは、Still Reactionと呼ばれる場合が多い)
続いて、ジョン・ケネス・スティル(John Kenneth Stille)は、1978年に穏やかな反応条件下で、さまざまなアルキルスズ試薬と多数のアリールおよびアシルハライドのカップリングを、はるかに優れた収率(76%-99%)で報告した。Stilleは1980年代にも、この広範で温和なプロセスを用いて多数のケトンを合成する研究を続け、この変換のメカニズムを解明した。
1980年代半ばまでに、スズが関与するカップリング反応の話題に関する65以上の論文が発表され、この反応の基質範囲の探求が続けられていた。この分野の初期の研究はアルキル基のカップリングに集中していたが、今後の研究のほとんどは、ビニル、アルケニル、アリール、アリル有機スタンナンとハロゲン化物との、より合成的に有用なカップリングを対象としたものであった。これらの有機スズ試薬は空気に対して安定であり、合成が容易であったため、Stille反応は有機合成の分野で一般的になった。
反応機構
Stille反応の基本的な機構は以下のステップで構成されます。
- 酸化的付加: パラジウム(0)触媒が有機ハロゲン化物と反応し、パラジウム(II)複合体を形成します。これは、酸化的付加と呼ばれる過程で、炭素−ハロゲン結合が分裂します。
- トランスメタル化: パラジウム(II)複合体と有機スズ化合物が反応し、炭素−炭素結合の形成に重要な炭素基がパラジウムに転移します。このステップでは、反応の速度や選択性が大きく影響を受けるため、多くの研究が行われています。
- 還元的脱離: 最終的にパラジウム(II)が還元され、炭素−炭素結合を持つ生成物が放出されます。これにより、パラジウム(0)触媒が再生され、反応サイクルが完了します。
実験手順
更新をお待ちください
実験のコツ
発展
機構の多様性
トランスメタル化の経路には、「開いた経路」と「閉じた経路」、および「イオン経路」があることが提案されています。これにより、立体選択性や副生成物の制御が可能となり、より複雑な分子の合成に応用されています。
配位子の役割
配位子は反応の効率と選択性に大きく影響を与えます。特に、かさ高いリン系配位子(例: PtBu₃)が有効で、難反応性のクロリド(Cl)やトリフレート(OTf)基を持つ化合物のカップリングに成功しています。
副生成物の抑制
反応の過程で発生する副生成物(特にスズ由来の化合物)による毒性が懸念されています。特に医薬品合成では、生成物中のスズ濃度を低く抑えるための方法が求められています。これに対して、スズ化合物の再利用や低毒性スズ化合物の使用が提案されています。
応用例
更新をお待ちください
参考文献
1) Carlos Cordovilla, et. al., ACS Catal. 2015, 5, 3040-3053. DOI: 10.1021/acscatal.5b00448
関連書籍








