pKaの考え方:暗記から比較へ(頻出パターン)
pKaを「数字の暗記」として扱うと、有機化学は一気に苦行になります。
でも実戦で必要なのは、細かい数値の丸暗記ではなく、(1)どちらが強酸か、(2)平衡がどちらに寄るか、(3)どのHが抜けやすいか、を素早く比較できることです。
この記事では、マクマリー(OpenStax版)のpKaの使い方と、講義・試験で頻出の比較パターンを「型」として固定します。
この記事でできること
- pKaの大小から「強酸・弱酸」「強塩基・弱塩基」を即判定できる
- 酸塩基平衡がどちらに進むか(進む/進まない)を比較で判断できる
- 頻出官能基のpKaレンジを“暗記最小”で整理できる
- 「なぜそのpKaになるか」を共鳴・誘起・混成(s性)で説明できる
結論:pKaは「比較ツール」
- pKaが小さいほど強酸(Kaが大きい)
- 強酸の共役塩基は弱塩基/弱酸の共役塩基は強塩基(逆関係)
- H+は「強酸 → 強塩基」へ移動する(=生成物側が“弱い酸・弱い塩基”になる方向が有利)
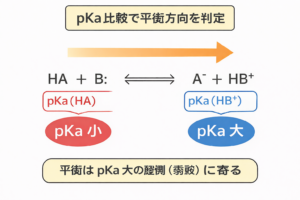
テンプレ:pKaで平衡を一発判定する
酸塩基反応の基本形
HA + B: ⇄ A− + HB+
判定ルール(これだけ)
- 左の酸:HA(pKa(HA))
- 右の酸:HB+(pKa(HB+))
- 平衡は「pKaが大きい酸(弱酸)がある側」に寄る
超重要:ΔpKaの感覚
実験・試験では「明らかに進む/ほぼ進まない」を判断したい場面が多い。
目安として:
- ΔpKaが数以上(例:3以上)なら、だいたい“進む”と見てよい
- ΔpKaが小さい(例:0〜1)なら、平衡で混ざる(条件依存)
※厳密な平衡定数計算は別記事で扱う
頻出パターン1:O–H酸(アルコール vs カルボン酸)
観察(典型pKa)
- 水:pKa 15.74
- エタノール:pKa 16.00
- 酢酸:pKa 4.76
なぜ?(共役塩基の安定性で説明)
アルコールがH+を失うとアルコキシド(RO−)になる。負電荷は主にO上に集中。
一方カルボン酸がH+を失うとカルボキシラート(RCO2−)になり、負電荷が共鳴で分散して安定。
つまり、共鳴で共役塩基が安定 → pKaが下がる(強酸化)。
頻出パターン2:フェノールがアルコールより酸性(共鳴)
ポイント
フェノールはアルコールよりずっと酸性(フェノキシドが共鳴安定化)。
負電荷がOだけでなく芳香環(o/p位)に分散するため、共役塩基が安定になる。
試験での使い方
- 「フェノールはNaOHに溶ける(塩になる)」は鉄板
- 置換基が電子求引性ならさらに酸性が上がる(共役塩基がより安定)
頻出パターン3:α水素(カルボニル隣)とエノラート(共鳴)
何が起きる?
C=Oの隣(α位)のHは「抜けるとエノラートになれる」ため、通常の炭化水素より酸性が高い。
エノラートは共鳴で負電荷がOとα炭素に分散して安定。
よく使う目安(pKaレンジ)
- アルコール:~16
- アルデヒド:~17、ケトン:~19
- 1,3-ジカルボニル:さらに酸性(~9〜13が目安)
頻出パターン4:末端アルキンが酸性(混成=s性)
観察(炭化水素のpKa)
- アルカン ~60、アルケン 44、末端アルキン 25
なぜ?(混成で説明)
アセチリド陰イオンはsp混成でs性が高く(50%)、負電荷が核に近い低エネルギー軌道に乗るため安定。
だから末端アルキンは相対的に酸性が高い。
頻出パターン5:誘起効果(−I)で酸性が上がる
代表例:フッ素置換アルコールが酸性化
電子求引性置換基(ハロゲンなど)があると、アルコキシドの負電荷が“分散”して安定化し、酸性が上がる。
例として、エタノール(pKa 16)に対し 2,2,2-トリフルオロエタノール(pKa 12.43)のようにpKaが下がる。
「暗記」から「比較」へ:最低限のpKa地図(覚えるのはレンジ)
まずはこの並びを固定
強酸(低pKa) ←──────────→ 弱酸(高pKa)
- 無機強酸(例:HCl)
- カルボン酸(~5)
- フェノール(~10前後が目安、置換基で変動)
- 水・アルコール(~16)
- α水素(アルデヒド~17、ケトン~19)
- 末端アルキン(~25)
- アミンの共役酸(アンモニウム)はpKaで塩基性を見る(別記事で詳説)
数字は「代表値を1つ」で十分
例:水15.7、酢酸4.8、末端アルキン25、ケトン19
これだけで、多くの“進む/進まない”が判定できる。
練習問題(演習)
解答:
できる(進む)。
酢酸(pKa 4.76)は水(pKa 15.74)より強酸なので、H+は酢酸→OH−へ移動して水ができる方向が有利。
解答:
ほぼできない(平衡は反応物側)。
アセトンはエタノールより弱酸(pKaが大きい)なので、エトキシドはアセトンのHを強くは奪えない。強塩基(例:LDAなど)が必要になる。
解答:
できる(進む)。
末端アルキン(pKa 25)はNH3(pKa 35)より強酸なので、NH2−は末端アルキンを脱プロトン化してアセチリドを与える。
次に読む記事
- 共鳴構造の書き方:電子はどこまで動かせる?(pKaの理由付けが強くなる)
- SN1/SN2の入口:基質・溶媒・求核剤で一発判定(塩基性/求核性の切り分けも含む)
- アミンの塩基性:pKa(アンモニウム)で見る(有機塩基の扱いを完成させる)








