求核剤・求電子剤の見分け方:反応点の探し方
反応機構(矢印)が書けない最大の原因は、「どこが反応点なのか」が見えていないことです。逆に言うと、求核剤(nucleophile)と求電子剤(electrophile)、そして分子内の“反応点”が判定できれば、機構の最初の矢印はほぼ自動で決まります。
この記事では、大学有機化学(講義〜定期試験)で通用するレベルを目標に、求核/求電子の判定→反応点の特定→矢印の出発点と到着点を、手順として固定します。
この記事でできること
- 求核剤・求電子剤を「電荷/孤立電子対/極性/π結合」で判定できる
- 分子のどこが反応点(求核部位・求電子部位)かを見つけられる
- 機構の最初の矢印(出発点→到着点)を迷わず書ける
- 中性分子が「両方になりうる」理由を説明できる
先に結論(ここだけ読めばOK)
反応点探索は、次の3ステップでほぼ完了します。
- Step1:電子が「ある」場所を探す(負電荷・孤立電子対・π結合)→ そこが求核点
- Step2:電子が「欲しい」場所を探す(正電荷・δ+・脱離基のついた炭素)→ そこが求電子点
- Step3:矢印は「求核源 → 求電子先」(出発点は電子対、到着点は電子不足)
中性分子でも、電子が濃い場所と薄い場所が同居するため、条件によって求核にも求電子にもなり得ます。
基本定義:求核剤・求電子剤とは
求核剤は電子に富み、電子対を与えることで結合を作ります。求電子剤は電子に乏しく、電子対を受け取ることで結合を作ります。
この2語は、ルイス塩基(電子対供与体)/ルイス酸(電子対受容体)と対応づけて理解すると整理が速くなります。
反応点を探す手順(テンプレ)
Step1:求核点(電子が濃い場所)をマーキング
まず「電子対を出せる場所」を探します。ここが矢印の出発点になりやすいです。
- 負電荷:O−、S−、CN−、X− など
- 孤立電子対:N、O、S、ハロゲン(中性でも持つ)
- π結合:アルケン、アルキン、芳香環(条件次第で求核として働く)
コツ:「負電荷 or 孤立電子対 or π結合」を見つけたら、とりあえずNu候補として丸をつけてOKです。
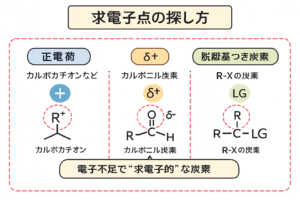
Step2:求電子点(電子が薄い場所)をマーキング
次に「電子対を受け取れる場所」を探します。ここが矢印の到着点になりやすいです。
- 正電荷:カルボカチオン、オニウムイオン(R3S+など)
- δ+:強く分極した結合の正側(典型は カルボニル炭素)
- 脱離基が付いた炭素:R–X の炭素(Xが抜ければ電子不足になりやすい)
- H+ を与えうる部位:酸性水素(条件で“求電子的H”になる)
Step3:矢印を1本だけ書く(最初の一手)
ここまで来たら、機構の第一歩は次の1行で決まります。
矢印は「求核源(電子対がある)→ 求電子先(電子不足)」
矢印の出発点は、孤立電子対・負電荷・π結合など電子対のある場所です。到着点は、正電荷・δ+など電子を受け取れる場所です。
中性分子が「両方になりうる」理由
中性分子でも、電子が濃い場所(求核点)があるなら、どこかに電子が薄い場所(求電子点)も同居します。たとえば水は、孤立電子対を使って求核として働く一方、条件によってはHを供与して求電子的(酸として)にも働きます。
またカルボニル化合物は、炭素が求電子点(δ+)であるのに対し、酸素が求核点(孤立電子対・δ−)になり得ます。つまり「分子=求核 or 求電子」と単純化せず、分子内の部位(サイト)で判断するのがコツです。
頻出の“見分け即答”リスト(最小セット)
求核剤になりやすい(Nu:)
- 陰イオン:HO−、RO−、RS−、CN−、X−
- 孤立電子対を持つ中性分子:NH3、RNH2、H2O、ROH(※強弱は状況で変化)
- π結合:アルケン、アルキン(酸付加などで求核として扱う場面が多い)
求電子剤になりやすい(E、E+)
- 陽イオン:カルボカチオン、ニトロニウム(NO2+)など
- 酸(H+供与):プロトン化できる種(反応開始の“求電子的H”)
- アルキルハライド(R–X)の炭素
- カルボニル炭素(C=O のC)
例題:反応点を3ステップで特定する
例1:アルケン + HBr(最初の矢印だけ)
Step1:アルケンのπ結合=求核点(電子対がある)
Step2:HBrのH=求電子点(H–Brは分極し、Hがδ+になりやすい)
Step3:矢印は「π結合 → H」
この1本が書ければ、次に生じるカチオン(求電子)へBr−が攻撃する、という流れも見えてきます。
例2:カルボニル + アニオン(求核付加の入口)
Step1:アニオン(例:CN−)=求核点
Step2:カルボニル炭素=求電子点(δ+)
Step3:矢印は「CN− → カルボニル炭素」
例3:R–X + Nu(置換の入口)
Step1:Nu(孤立電子対/負電荷)=求核点
Step2:R–Xの炭素=求電子点(Xが脱離基)
Step3:矢印は「Nu → 炭素」
よくあるミスと対策
「化合物全体」で求核/求電子を決め打ちする
中性分子は部位によって性格が違うことが多いです。水・アミン・カルボニルなどは典型で、サイト(反応点)で判断しましょう。
矢印の出発点が“原子”になっている
矢印は「原子」ではなく電子対から出します。孤立電子対、負電荷、π結合の中心(=電子対)を出発点にする癖をつけてください。
求核性と塩基性を同一視する
強塩基=強求核になりやすい場面は多い一方、溶媒や立体障害で逆転することもあります。まずは本記事のテンプレで「反応点」を外さず、その上で条件(溶媒・混み合い)を別記事で調整するのが安全です。
練習問題(演習)
次の各問で、(1)求核点 (2)求電子点 (3)最初の矢印を1本だけ書くつもりで、文章で答えてください。
問題1
求核点:NH3 の N 原子上の孤立電子対(N:)
求電子点:CH3Cl の C 原子(C–Cl 結合が分極し、C が δ+/Cl が脱離基になり得る)
最初の矢印:N の孤立電子対 → CH3Cl の C 原子
問題2
求核点:CN−(実質的には C 端が求核点になりやすい)
求電子点:アルデヒドのカルボニル炭素(C=O の C が δ+)
最初の矢印:CN− の C 端 → カルボニル炭素(π結合電子は O へ押し上げられる流れになる)
問題3
求核源:アルケンの π 結合(電子対)
求電子先:HBr の H(H–Br が分極し H が δ+)
最初の矢印:C=C の π 結合 → H(同時に H–Br 結合の電子対は Br へ移動して Br− が生じる)
次に読む記事(この理解を“機構”に変える)
- 反応機構の矢印ルール:出発点と到着点の作法
- 電気陰性度と結合の極性:δ+/δ−の付け方
- 共鳴構造の書き方:電子はどこまで動かせる?
- SN1/SN2の入口:基質・溶媒・求核剤で一発判定






