ウォルフ転位【Wolff Rearrangement】
ウォルフ転位は、α-ジアゾカルボニル化合物が二窒素を失ってケテンに転化し、それに伴って1,2転位が起こる反応である。
概要
- ジアゾケトンの脱窒素で生じたカルベンがケテンに転位する反応
- 中間体としてケテンが生成し、水、アルコール、アミンなどの弱酸性の求核剤で求核攻撃を受け、カルボン酸誘導体を生成したり、[2+2]環化付加反応により四員環を生成したりすることができる
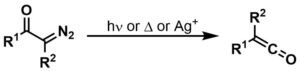
歴史
1902年にLudwig Wolffらによって発見された。
1902年、Wolffはジアゾアセトフェノンを酸化銀(I)および水で処理するとフェニル酢酸が生成することを発見した。同様に、酸化銀 (I) とアンモニアで処理するとフェニルアセトアミドが生成した。数年後、Schröterは独自の研究で同様の結果を観察した。この反応は、Wolff-Schröter転位と呼ばれることがある。1930年代までは、ジアゾケトンの合成は不可能であったため、Wolff転位は発見から20年経たないと一般には使われない。この反応は有機合成化学において有用であることが証明されており、多くのレビューが出版されている。
反応機構
Wolff転位の機構については、協調的な機構と段階的な機構がしばしば競合するため、多くの議論がなされてきた。しかし、メカニズムの2つの側面については同意することができる。まず、α-ジアゾカルボニル化合物はs-cis型とs-trans型の平衡状態にあり、その分布が反応機構に影響を与える可能性がある。一般に、光分解下では、離脱基と移動基の反平面関係により、s-cis型の化合物は協調的に反応するが、s-trans型の化合物はカルベン中間体を介して段階的に反応するか、転位しない。第二に、反応機構にかかわらず、転位によりケテン中間体が生成し、これをアルコールやアミンなどの弱酸性の求核剤で捕捉して対応するエステルやアミド、あるいはオレフィンで[2+2]環化付加体を与えることが可能である。強酸は転位せず、α-炭素をプロトン化し、SN2生成物を与える。
実験手順
実験のコツ
発展
応用例
参考文献
1) Wolff, L. Liebigs Ann. Chem. 1902, 325, 129.
2) Wolff, L. Ann. 1912, 394, 25.
3) Meier, H.; Zeller, K.-P. Angew. Chem. Int. Ed. Engl. 1975, 14, 32. doi:10.1002/anie.197500321
4) Torres, M.; Lown, W. M.; Gunning, H. E.; Strausz, O. P. Pure Appl. Chem. 1980, 52, 1623. doi:10.1351/pac198052061623
5) Gill, G. B. Comprehensive Organic Synthesis 1991, 3, 887.
6) Yogev. A.; Loewenstein, R. M. J.; Amar, D. Chem. Rev. 1994, 94, 1091. DOI: 10.1021/ja00759a010
7) Kirmse, W. Eur. J. Org. Chem. 2002, 2193.
関連書籍






