アセト酢酸エステル合成【Acetoacetic Ester Synthesis】

アセト酢酸エステル合成とは、3-オキソブタン酸エステル(アセト酢酸エステル)のC-アルキル化によるケトンの合成です。
概要
アセト酢酸エステルは、C2位あるいはC2位とC4位の両方がプロトン化される。C2位のみであるかC2位とC4位の両方であるかは、使用する塩基の量に依存する。
C2位の炭素上のC-H結合は2つの隣接するカルボニル基の電子求引効果(誘起効果)により活性化されており、これらのプロトンはかなり酸性(C2位:pKa~11, C4位:pKa~24)である。
pKaからわかるように、出発原料に対して1当量あるいは2当量の塩基を用いればC2位のみ、過剰量の塩基を用いればC2位とC4位の両方がプロトン化される。
過剰量の塩基で処理したジアニオンに求電子剤を加えると、アルキル化は求核性の高いC4位で優先して起こる。
そこで生じたアセト酢酸エステル誘導体は以下の2通りの加水分解を行うことができる。
- ケトン(一置換あるいは二置換アセトン誘導体)の生成
- 逆Claisen反応によるカルボン酸の生成
加水分解には、よく希酸を用いるが、これは副生成物が反応液と混ざらないためである。
最近では、Krapcho脱炭酸反応が中世条件での脱炭酸条件として使われることが多い。
マロン酸エステルと同様に、アセト酢酸エステルのモノアルキル誘導体はヨウ素の存在下で塩基触媒のカップリングが進行する。
カップリングの生成物は、加水分解と脱炭酸によってγ-ジケトンとなる。
出発原料のアセト酢酸エステルは、それに対応するエステルのClaisen縮合により合成することが多い。
アセト酢酸エステル合成と似た手法として、マロン酸エステル合成がある。
歴史
更新をお待ちください。
反応機構
アルキル化:
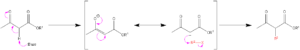
加水分解・脱カルボニル化:
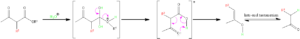
反応例
脱炭酸時に酸/塩基条件下に伏したくないときはメチルエステルを用いたKrapcho法が頻用される。
辻-Trost反応やMichael反応条件が化学選択的アルキル化においては頻用される。
β-ケトカルボニル化合物に対して強塩基を2当量以上用いると、通常とは異なる位置をアルキル化することが可能。このジアニオンは大変高い求核能をもち、混み合った反応性が低い位置でもアルキル化が起こせる。
実験手順
更新をお待ちください。
応用例
H. HiemstraによるソラノエクレポンAのビシクロ[2. 1. 1]ヘキサン基本骨格の合成
H. Hiemstraらは、ソラノエクレポンAのビシクロ[2. 1. 1]ヘキサン基本骨格(bicyclo [2.1.1] hexane substructure of solanoeclepin A)の合成を分子内ジオキセノンーアルケン[2+2]光環化付加反応を用いて行いました。
ジオキセノン前駆体は、入手が容易なアセト酢酸t-ブチルエステルからアセト酢酸エステル合成を用いて調製できます。
ジオキセノン誘導体にUV照射することにより、4時間程で満足できる収率の環化付加体が得られます。
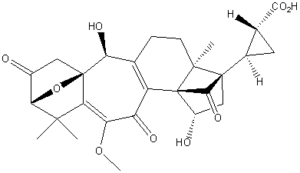 ソラノエクレピンA
ソラノエクレピンAR. Neierによる置換2-ヒドロキシ-3-アセチルフランの合成
R. Neierらは、アセト酢酸t-ブチルエステルをα-ハロゲンでアルキル化し、トリフルオロ酢酸で処理することにより、置換2-ヒドロキシ-3-アセチルフラン(substituted 2-hydroxy-3-acetylfurans)を合成した。
β-ケトエステルとα-ハロケトンからフランを合成する反応は、Feist-Benary反応として知られています。
C2位がアルキル化された中間体を臭化アルキルでもう一度アルキル化すると、2,2-二置換生成物が得られ、これをTFAで処理すると三置換フランが得られます。
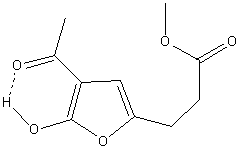 2-ヒドロキシ-3-アセチルフラン誘導体
2-ヒドロキシ-3-アセチルフラン誘導体中田によるテトラヒドロフランの合成
中田らは、アセト酢酸エステルの字アニオンとエピブロモヒドリン誘導体との反応によるテトラヒドロフラン(tetrahydrofuran)の新合成法を開発しました。
テトラヒドロフラン誘導体の選択的合成は、LiClO4を添加剤として使うことで達成されました。
C. H. heathcockによるステモナアルカロイドのコア構造の合成
C. H. heathcockらは、ステモナアルカロイドの典型的なコア構造の合成法を開発しました。
1-アザビシクロ [5.3.0] デカン環系(1-azabicyclo [5.3.0] decane ring system)の前駆体はアセト酢酸エチルのジアニオンの連続二重アルキル化によって合成されました。
関連書籍








