物理に関する知識【甲種危険物取扱者】
甲種危険物取扱者試験は、危険物を取り扱う人には必須の試験と言えるくらい重要な国家資格です。
本記事では、「物理学及び化学」の物理に関する化学について解説します。
物質の状態の変化
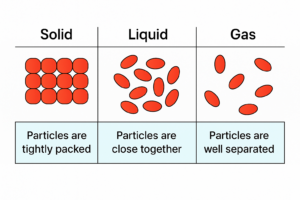
一般的に、物質には固体、液体、気体の三つの状態が存在します。
これを物質の三態と言います。
物質の三態
物質の三態は、温度や圧力を変えることによって状態を変化させます。
融解
融解とは、物質が固体から液体へ変わる現象で、たとえば氷が水になるのがその例です。
このときに必要な熱を融解熱といい、固体をそのままの温度で溶かすために使われるエネルギーです。
融解熱は温度を上げるのではなく、固体の粒子の並びを崩すために使われます。
凝固
凝固とは、物質が液体から固体に変わる現象で、たとえば水が氷になるのがその例です。
このときに放出される熱を凝固熱といい、液体の粒子が規則正しく並び固体になるときに放出されるエネルギーです。
凝固熱は融解熱と同じ量で、温度は変わらず、すべてが状態変化に使われます。
蒸発
蒸発とは、液体が気体に変わる現象で、特に液体の表面から分子が飛び出して気体になる過程を指します。たとえば、水たまりが自然に乾くのは蒸発の例です。
このときに必要なエネルギーを蒸発熱(または気化熱)といい、液体の分子が気体になるために外から熱を吸収します。
蒸発は温度に関係なく液体表面で常に起こっており、温度が高いほど速く進行します。
凝縮
凝縮とは、気体が液体に変わる現象で、たとえば水蒸気が冷えて水滴になるのがその例です。
このときに放出されるエネルギーを凝縮熱といい、気体の分子が液体になるときに熱を外へ放出します。
凝縮熱は蒸発熱と同じ量で、温度は変わらず、すべてが状態変化に使われます。
昇華
昇華とは、物質が固体から直接気体に変わる、または気体から直接固体に変わる現象です。
例えば、ドライアイス(二酸化炭素の固体)が液体にならずに気体になるのは昇華の例です。また、霜ができるのは水蒸気が直接氷になる昇華です。
昇華には多くのエネルギーが必要で、昇華熱と呼ばれる熱が吸収または放出されます。この熱は、融解と蒸発を合わせたエネルギー量に相当します。
昇華は特定の物質でのみ観察され、状態変化の中でもやや特殊な現象です。
密度と比重
密度
密度とは、物質の単位体積あたりの質量を表す値で、「どれだけ詰まっているか」を示す指標です。
式で表すと、
密度 = 質量 ÷ 体積
単位は通常「g/cm3」や「kg/m3」で表されます。
同じ体積でも重ければ密度が大きく、軽ければ密度は小さくなります。
比重
比重とは、ある物質の密度が基準となる物質の密度に対してどれだけの割合かを示す比率のことです。単位はありません(無次元量)
比重は、物質の「重さの感じやすさ」を比較するのに使われますが、密度そのものではなく、密度の比較値である点がポイントです。
- 固体・液体の場合の比重
固体や液体の比重は、水(4℃の水)の密度(1.00 g/cm³)を基準とします。
- 気体の場合の比重
気体の比重は、通常 空気(または水素) を基準とします。どちらを基準にするかは文脈によって異なります。
空気を基準にした比重(工業的に一般的):
沸騰と沸点
沸騰とは、液体が加熱されて内部から気泡を生じて激しく蒸発する現象です。このとき、液体の蒸気圧が外気圧と等しくなった温度を沸点といいます。
液体の沸点は外気圧によって変わります。
たとえば、標準大気圧(1気圧または標準気圧)のときの水の沸点は 100℃ であり、これが「水の沸点」として一般に知られています。
外気圧が高くなると、それに打ち勝つためにより高い温度が必要になるため、沸点は上昇します。これを沸点上昇といいます。
逆に標高が高く気圧が低い場所では、沸騰がより低い温度で起こります。
気体の性質
臨界温度と臨界圧力
臨界温度とは、どれだけ圧力をかけても気体を液体にできなくなる温度の限界のことです。これより高い温度では、気体は圧縮しても液体になりません。
臨界圧力とは、その臨界温度で気体を液体に変えるのに必要な最小の圧力です。
つまり、ある物質を気体から液体にしようとするとき、温度が臨界温度以下で、かつ圧力が臨界圧力以上である必要があります。
たとえば、水の臨界温度は約374℃、臨界圧力は約22.1MPaです。
ボイル・シャルルの法則
ボイルの法則
温度が一定のとき、気体の圧力が高くなると体積は小さくなり、圧力が低くなると体積は大きくなるという関係です。
\[
P \times V = k \quad (k = const.)
\]
圧力\(P\):外から押す力
体積\(V\):気体の広がり
例:注射器の口をふさいで押すと中の気体が縮むのはボイルの法則の例です。
シャルルの法則
圧力が一定のとき、
気体の温度が高くなると体積も大きくなり、温度が低くなると体積も小さくなるという関係です。
\[
\frac{V}{T} = k \quad (k = const.)
\]
温度\(T\)は絶対温度(K)で表します
例:風船を温めると膨らみ、冷やすとしぼむのはシャルルの法則です。
ボイル・シャルルの法則
気体の圧力、体積、温度の3つの関係をまとめた法則です。
\[
\frac{P \times V}{T} = k \quad (k = const)
\]
この式は理想気体のふるまいを表しており、条件が変化してもこの比が一定になります。
例:気球の気体が上昇しながら膨張したり冷えたりする様子などは、この法則で説明されます。
気体の状態方程式
気体定数
国際単位系(SI)での値は:
\[
R = 8.314 J mol^{-1} K^{-1}
\]
気体の状態方程式
気体の状態方程式とは、気体の圧力\(P\)・体積\(V\)・温度\(T\)・物質量\(n\)の関係を表す式で、理想気体に対して次のように表されます:
\[
PV = nRT
\]
\(P\):圧力 [Pa]
\(V\):体積 [m3]
\(n\):物質量 [mol]
\(R\):気体定数(8.314 J/mol·K)
\(T\):絶対温度 [K]
ドルトンの法則
ドルトンの法則(分圧の法則)とは、混合気体全体の圧力は、各成分気体の圧力(分圧)の合計に等しいという法則です。
\[
P_{total} = P_1 + P_2 + P_3 + \cdots
\]
\(P_{total}\):混合気体全体の圧力
\(P_1 , P_2 , \cdots\):各成分気体の分圧(その気体だけが入っていた場合の圧力)
熱
熱量の単位と計算
絶対温度
絶対温度とは、物質の熱運動の強さを示す温度で、基準となる0 K(絶対零度)はすべての分子の運動が停止するとされる理論上の最低温度です。単位はケルビン(K)が使われ、セルシウス温度に273.15を加えることで求められます(例:25℃=298.15 K)。気体の法則など正確な物理化学的計算では、温度を絶対温度で扱うことが必要とされます。
熱量の単位
熱量の単位には ジュール(J) が使われ、これはエネルギーの国際単位系(SI)における標準的な表現です。かつてはカロリー [cal] も一般的に使われており、1 cal は約 4.184 J に相当します。カロリーは「水1 gの温度を1℃上げるのに必要な熱量」として定義されていましたが、現在ではジュール表記が主流です。つまり、熱量とはエネルギーの一種であり、その単位はジュールで表すのが現代の科学の基本です。
比熱と熱容量
比熱とは、物質1gの温度を1℃(または1K)上げるのに必要な熱量のことです。単位は通常J/(g·K) で表されます。物質ごとに値が異なり、水の比熱(約 4.18 J/g·K)は特に大きいことで知られています。
一方、熱容量とは、ある物体全体の温度を1℃(または1K)上げるのに必要な熱量を表し、単位は J/K です。これは「物の大きさや質量」に依存する値であり、比熱と区別されます。
つまり、比熱は「1gあたり」、熱容量は「物体全体」に対する熱のかかりやすさを示しています。
熱量の計算
熱量の計算は、次の公式で求めることができます:
\[
Q = mc /Delta T
\]
\(Q\):熱量 [J]
\(m\):質量 [g]
\(c\):比熱 [J g-1 K-1]
\(\Delta T\):温度変化 [K]
この式は、物体がどれだけの質量をもち、どれくらいの温度変化があり、どのくらい熱をためやすいか(比熱)を掛け合わせて、加えられたまたは失われた熱量を計算するものです。
たとえば、水100gを20℃から50℃まで温めたときの熱量は:
\[
Q = 100 \times 4.18 \times (50 – 20) = 12540
\]
このようにして、加熱や冷却に必要なエネルギーを求めることができます。
熱の移動
伝導
物体内で熱がじわじわと伝わる現象です。金属のスプーンを熱いスープに入れると、持ち手まで熱くなるのは伝導によるものです。分子同士の接触によって熱が伝わります。
対流
液体や気体が動くことで熱が運ばれる現象です。たとえば、お湯を沸かすと底の水が温まり、上昇して全体が温まるのは対流によるものです。流体が移動することで熱を運びます。
放射(ふく射)
赤外線などの電磁波によって熱が伝わる現象です。火や太陽の熱が空気を介さずに体に届くのは放射によるものです。物質を介さず、真空中でも熱が伝わります。
熱膨張
熱膨張とは、物質が温められると体積が大きくなる現象です。これは、加熱によって分子の運動が活発になり、分子間の間隔が広がるために起こります。
熱膨張は固体・液体・気体すべての状態で起こりますが、特に気体ではその影響が大きくなります。つまり、温度が上がると物体は「広がる」性質をもつのです。
気体の断熱変化
気体の断熱変化とは、外部との熱のやり取りを行わずに気体の状態(温度・圧力・体積)が変化することを指します。つまり、熱の出入り(熱量\(Q\)がゼロの状態で変化が起こります。
断熱変化では気体自身の内部エネルギーの変化によって温度が上下し、熱の出入りはゼロであることが特徴です。
静電気
静電気とは
静電気とは、物体にたまった電気(電荷)が動かずにその場にとどまっている状態の電気です。物体同士がこすれ合うと、電子が一方から他方へ移動し、電荷の偏りが生じます。その結果、片方は正の電気(+)、もう片方は負の電気(−)を帯びます。乾燥した空気中では電気が逃げにくいため、こうした電気が物体にたまりやすく、ドアノブに触れたときなどに一気に放電してパチッと感じる現象が起こります。
静電気による放電
静電気による放電とは、物体にたまった電気(静電気)が一気に他の物体に流れ出す現象です。たとえば、乾燥した日にドアノブに触れて「パチッ」と感じるのは、体にたまっていた静電気が金属を通じて一瞬で放電されたためです。
電気は電圧の高いところから低いところへ流れようとする性質があり、たまった電荷が限界に達すると、空気中でも一気に流れ出して放電が起こります。このとき、小さな火花や痛み、音が発生することがあります。放電は一瞬で終わりますが、電子の移動によるエネルギーが一気に解放されるため、身近でもよく感じる現象です。
静電気が発生しやすい条件
静電気が発生しやすい条件は、乾燥した空気摩擦が起きやすい物質の組み合わせです。
特に湿度が低い冬は、空気中の水分が少なくて電気が逃げにくくなるため、物体に電気がたまりやすくなります。また、ナイロンやポリエステルなどの合成繊維の服を着ていると、こすれによって静電気が発生しやすくなります。床を歩くときの靴底とカーペットの摩擦なども、よくある原因です。
つまり、乾燥していて・よくこすれ・電気が逃げにくい環境が静電気を生じやすくします。







