原子の基本的な構造は、高校で習うと思う。本記事では、その内容を大学有機化学に発展させ、解説する。
原子の構造
原子は、原子核と電子から成る。原子核は密度が大きく、正に帯電している。電子は負に帯電しており、原子核の周りをやや離れて取り巻いている。
原子核
原子核は、電気的に中性な中性子という粒子と、正に帯電した陽子という粒子で構成されている。
原子核は非常に小さい。直径は、約10-14~10-15メートルである。しかし、原子の質量はほぼ原子核の質量で決まる。
原子を表すとき、原子核中の陽子の数と同じである原子番号と、陽子と中性子の和である質量数を用いる。ある元素の原子は、すべて同じ原子番号を有する。一方、質量数は中性子の数によって異なる。同じ原子番号を持ち、質量数が異なる原子を同位体と呼ぶ。
電子
電子は、原子核の周りを約10-10メートル離れて回っており、無視できるほどの質量しかない。原子の直径は電子によって決まり、約2×10-10メートルである。電子の動いている範囲は、軌道と呼ばれる。
原子の大きさを表す際、数値を単純にするために、オングストローム(Å)単位(1 Å=10-10 m)を用いることもある。
軌道
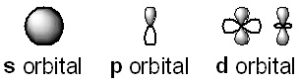
軌道には、s、p、d、fと名付けられた4種類の形がある。s軌道は原子核を中心に球形をしている。p軌道はダンベルのような形をしている。d軌道は5つあり、そのうち4つはクローバー形、1つは縦長のダンベルの中央にドーナツを配したような形をしている。有機化学では、s軌道とp軌道が重要となる。
原子中の軌道は、その空間的大きさとエネルギーの順番によって、電子殻に分けられている。異なる殻には数と種類が異なる軌道があり、それぞれの軌道に2つの電子が収容できる。1番目の殻は、1つのs軌道から成る。2番目の殻は、1つのs軌道と3つのp軌道から成る。3番目の殻は、1つのs軌道、3つのp軌道、5つのd軌道から成る。それぞれの軌道は殻と軌道の種類によって名付けられる。1番目の殻のs軌道は、1s軌道である。
ある殻内の3つのp軌道は、互いに直交する方向に向いており、px、py、pzと呼ばれる。それぞれのp軌道の2つのローブ間を分ける平面は電子密度が0の領域であり、節と呼ばれる。
電子配置
ある原子の最低エネルギーの電子配置である基底状態の電子配置は、次の3つの規則によって決まる。
- 1s → 2s → 2p →3s → 3p → 4s → 3d の順序に従い、エネルギーの低い軌道から順に電子が収容される。
- 電子は軸の周りを回転しているかのようにふるまう。この回転には2種類の方向があり、上向き(↑)と下向き(↓)で示される。1つの軌道に収容される2つの電子は、互いに逆向きのスピンでならなければならない。これをPauliの排他原理と呼ぶ。
- 2つ以上のエネルギーが等しい空の軌道がある場合、それらの軌道がすべて半分占有されるまで1つの軌道を1つの電子が占める。それらの電子はすべて同じ向きのスピンをもつ。これをHundの法則と呼ぶ。
以上が、原子の電子配置に関する規則である。
1. 次の元素の基底状態の電子配置を示せ。
(a) 水素 (b) 炭素 (c) 酸素 (d) 窒素 (e) リン
2. 次の元素の最外殻にある電子の数を示せ。
(a) マグネシウム (b) コバルト (c) セレン






