クライゼン縮合【Claisen Condensation】
クライゼン縮合は、強塩基の存在下、2つのエステルまたは1つのエステルと別のカルボニル化合物の間で起こる炭素-炭素結合形成反応で、β-ケトエステルまたはβ-ジケトンが生成される。ライナー・ルートヴィヒ・クライゼンが1887年に発表した反応にちなんで命名された。
概要
- 少なくとも一方の試薬はエノール化可能(α-プロトンを持ち、脱プロトン化によりエノラートアニオンを形成できる)でなければならない。エノール化可能なカルボニル化合物とエノール化不可能なカルボニル化合物の組み合わせで、いくつかの異なるタイプのクライゼンが形成されます。
- 使用する塩基は、カルボニル炭素との求核置換反応や付加反応を起こして、反応を妨害してはならない。このため、アルコキシドが再生されることから、生成するアルコールの共役ナトリウムアルコキシド塩基(例えばエタノールが生成する場合はナトリウムエトキシド)を用いることが多い。混合クライゼン縮合では、1つの化合物のみがエノール化可能であるため、リチウムジイソプロピルアミド(LDA)のような非求核性塩基を用いることができる。LDAは、親電子性エステルのエノール化のため、古典的なクライゼン縮合やディークマン縮合ではあまり使用されない。
- エステルのアルコキシ部分は、比較的良好な脱離基である必要があります。メチルエステルやエチルエステルは、それぞれメトキシドやエトキシドを生成するため、一般的に使用されている。
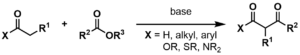
歴史
更新をお待ちください。
反応機構
この機構では、まず強塩基によってα-プロトンが除去され、電子の非局在化によって比較的安定なエノラートアニオンが形成される。次に、(もう一方の)エステルのカルボニル炭素がエノラートアニオンによって求核的に攻撃される。次にアルコキシ基が脱離し(アルコキシドの(再)生成)、アルコキシドが新たに生成した二重α-プロトンを除去して、共鳴安定性の高い新たなエノラートアニオンを形成する。最終段階で水性酸(硫酸またはリン酸など)を加えて、エノラートとまだ存在する塩基を中和する。新しく生成したβ-ケトエステルまたはβ-ジケトンは、その後単離される。この反応は、二重のα-プロトンの除去が熱力学的に他のエンドエルゴニック反応を駆動するため、化学量論的な量の塩基を必要とすることに注意。つまり、α水素が1つしかない基質では、最後のステップでβ-ケトエステルの脱プロトン化が駆動力となるため、クライゼン縮合はうまくいかないのである。
実験手順
更新をお待ちください。
応用例
関連反応
- Aldol condensation
- Fatty acid synthesis
- Polyketide synthase
- Dieckmann condensation
関連書籍
リンク
リンク
リンク







